Nature:破解癌细胞化疗耐药新机制,一作已回国加入中国科学院
来源:生物世界 2025-03-30 17:26
该研究发现了细胞内的活性氧(ROS)水平通过 VPS35 传递至质膜,从而调节线粒体翻译,将细胞质中的活性氧感知与线粒体中的活性氧生成联系起来。
活性氧(ROS)是包括癌症以及神经退行性疾病在内的人类病理的基础。然而,通过其半胱氨酸残基感知活性氧水平并调节其生成的蛋白质,目前仍不明确。
最近,国际顶尖学术期刊 Nature 发表了一项突破性研究,揭示了癌细胞感知氧化应激的全新机制——VPS35 蛋白通过感知活性氧(ROS)信号调控线粒体功能,最终决定癌细胞对化疗药物的生死抉择。
这项发现不仅刷新了科学界对细胞信号传递的认知,更为破解卵巢癌等恶性肿瘤的耐药难题提供了全新靶点。
该研究以Oxidation of retromer complex controls mitochondrial translation 为题,于 2025年3月26日发表在了 Nature 期刊,该研究发现了细胞内的活性氧(ROS)水平通过 VPS35 传递至质膜,从而调节线粒体翻译,将细胞质中的活性氧感知与线粒体中的活性氧生成联系起来。
张俊兵博士为论文第一作者兼共同通讯作者,张俊兵博士已于2025年2月加入中国科学院上海营养与健康研究所,任研究员。

活性氧:癌细胞的双刃剑
活性氧(ROS)如同细胞内的化学信使,低浓度时促进细胞增殖,过量时则引发 DNA 损伤。线粒体作为细胞的“发电厂”,正是活性氧的主要产地。传统观点认为,抗癌药物通过升高活性氧水平杀死癌细胞,但这项最新研究发现:某些癌细胞竟能通过主动调低线粒体活性来化解药物攻击!
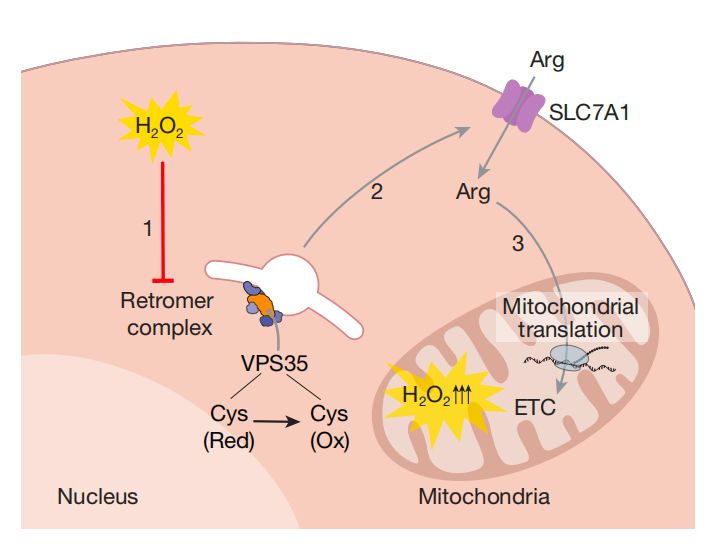
关键突破:研究团队通过系统性碱基编辑和计算筛选,对 25000 多个蛋白质的半胱氨酸位点进行系统性筛选,最终锁定逆转运复合体(retromer complex)核心蛋白 VPS35 的两个关键氧化感应位点——C653 和 C673。
VPS35:细胞内的氧化警报器
当细胞内过氧化氢(H₂O₂)水平升高时:
1、警报触发: H₂O₂ 使 VPS35 的 C653/C673 位点发生修饰;
2、系统解体: 氧化后的 VPS35 无法维持逆转运复合体结构,导致这个复合体分崩离析;
3、运输中断: 逆转运复合体底物 SLC7A1 无法抵达细胞膜,切断精氨酸供应;
4、能量调控: 线粒体翻译停工,活性氧产量骤降,癌细胞进入低耗能保护模式。
破解卵巢癌耐药密码
研究团队通过对临床数据的进一步分析发现:
预后指标: VPS35 高表达的卵巢癌患者铂类药物敏感期延长 6.8 个月;
耐药模型: 人为降低 VPS35 水平或模拟其氧化状态,癌细胞对顺铂耐药性提升 15 倍;
分子证据: 铂类耐药复发的肿瘤组织中,VPS35 表达量普遍低于初治肿瘤。
机制揭秘:通过“线粒体翻译减速→活性氧生成减少→药物杀伤失效”的级联反应,癌细胞成功构筑起耐药防线。这解释了为何传统抗氧化疗法在某些场景下适得其反。
改写抗癌策略的新曙光
这项研究发现了细胞质到线粒体的全新活性氧信号通路,表明了线粒体翻译速率可作为动态调控靶点,提示了联合抑制 VPS35 氧化通路可能增强化疗敏感性。
在此基础上,我们可以开发针对 VPS35 氧化位点的小分子抑制剂、建立线粒体翻译活性检测的临床评估体系,探索“代谢重编程+化疗”的联合治疗方案。
这项研究犹如为抗癌战争点亮了新的战略地图。当我们破解了癌细胞通过“氧化警报系统”逃逸杀伤的密码,距离精准瓦解肿瘤耐药防线又近了一步。或许在不远的未来,通过调控这个精妙的分子开关,我们就能让更多化疗药物面对癌细胞重新亮剑。
张俊兵,于山东大学生命科学学院获得学士和硕士学位,2019年于北京生命科学研究所获得博士学位,2019-2024年在哈佛大学医学院麻省总医院进行博士后研究,此后在哈佛大学任讲师,2025年2月加入中国科学院上海营养与健康研究所,任研究员,建立细胞代谢与疾病干预实验室。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


